Связь двух атомов может осуществляться более чем одной парой электронов. Такая связь называется кратной. Примером образования кратной связи может служить молекула азота. В молекуле азота px-орбитали образуют одну σ-связь. При образовании связи pz-орбиталями возникают две области 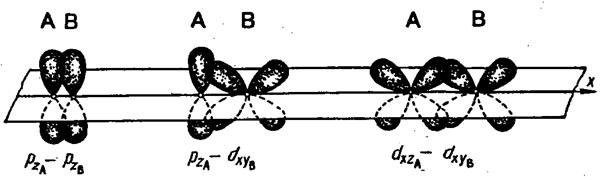 перекрывания – выше и ниже оси х:
перекрывания – выше и ниже оси х:
Такая связь называется пи-связью (π-связь). Возникновение π-связи между двумя атомами происходит только тогда, когда они уже связаны σ-связью. Вторую π-связь в молекуле азота образуют ру-орбитали атомов. При образовании π-связей электронные облака перекрываются меньше, чем в случае σ-связей. Вследствие этого π-связи, как правило, менее прочны, чем σ-связи, образованные теми же атомными орбиталями.
р-орбитали могут образовывать как σ-, так и π-связи; в кратных связях одна из них обязательно является σ-связью: 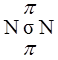 .
.
Таким образом, в молекуле азота из трех связей одна - σ-связь и две - π-связи.
Длиной связи называется расстояние между ядрами связанных атомов. Длины связей в различных соединениях имеют величины десятых долей нанометра. При увеличении кратности длины связей уменьшаются: длины связей N–N , N=N и NºN равны 0,145; 0,125 и 0,109 нм (10-9 м), а длины связей C-C, C=C и CºC равны, соответственно, 0,154; 0,134 и 0,120 нм.
Между разными атомами чистая ковалентная связь может проявляться, если электроотрицаельность (ЭО)1 атомов одинакова. Такие молекулы электросимметричны, т.е. «центры тяжести» положительных зарядов ядер и отрицательных зарядов электронов совпадают в одной точке, поэтому их называют неполярными.
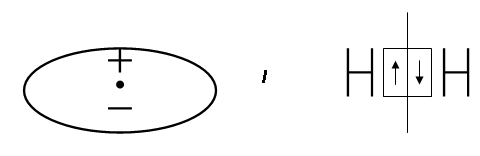
Если соединяющиеся атомы обладают различной ЭО, то электронное облако, находящееся между ними, смещается из симметричного положения ближе к атому с большей ЭО:
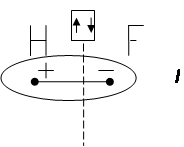
Смещение электронного облака называется поляризацией. В результате односторонней поляризации центры тяжести положительных и отрицательных зарядов в молекуле не совпадают в одной точке, между ними возникает некоторое расстояние (l). Такие молекулы называются полярными или диполями, а связь между атомами в них называется полярной.
Полярная связь – разновидность ковалентной связи, претерпевшей незначительную одностороннюю поляризацию. Расстояние между «центрами тяжести» положительных и отрицательных зарядов в молекуле называется длиной диполя. Естественно, что чем больше поляризация, тем больше длина диполя и больше полярность молекул. Для оценки полярности молекул обычно пользуются постоянным дипольным моментом (Мр), представляющим собой произведение величины элементарного электрического заряда (e) на длину диполя (l), т.е. 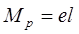 .
.
Дипольные моменты измеряют в дебаях Д (Д = 10-18 эл. ст. ед. × см, т.к. элементарный заряд равен 4,810-10 эл. ст. ед., а длина диполя в среднем равна расстоянию между двумя ядрами атомов, т.е. 10-8 см) или кулонометрах (Кл×м) (1 Д = 3,33·10-30 Кл×м) (заряд электрона 1,6·10-19 Кл умноженный на расстояние между зарядами, например, 0,1 нм, тогда Мр = 1,6·10-19×1×10-10 = 1,6·10-29 Кл · м). Постоянные дипольные моменты молекул имеют значения от нуля до 10 Д.
У неполярных молекул l = 0 и Мр = 0, т.е. они не обладают дипольным моментом. У полярных молекул Мр > 0 и достигает значений 3,5 – 4,0 Д.
При очень большой разности ЭО у атомов имеет место явная односторонняя поляризация: электронное облако связи максимально смещается в сторону атома с наибольшей ЭО, атомы переходят в противоположно заряженные ионы и возникает ионная молекула:
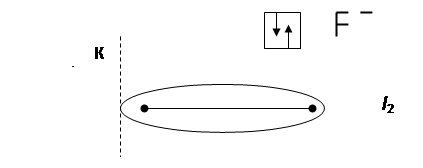
Ковалентная связь становится ионной. Электроасимметрия молекул возрастает, длина диполя увеличивается, дипольный момент возрастает до 10 Д.
Суммарный дипольный момент сложной молекулы можно считать равным векторной сумме дипольных моментов отдельных связей. Дипольный момент обычно принято считать направленным от положительного конца диполя к отрицательному.
Предсказать полярность связи можно с помощью относительной ЭО атомов. Чем больше разность относительных ЭО атомов, тем сильнее выражена полярность: DЭО = 0 – неполярная ковалентная связь; DЭО = 0 – 2 – полярная ковалентная связь; DЭО = 2 – ионная связь. Правильнее говорить о степени ионности связи, поскольку связи не бывают ионными на 100%. Даже в соединении CsF связь ионная только на 89%.
Перейти на страницу:
1 2 3