Белки. Из всех органических веществ в клетке ведущая роль принадлежит белкам. Белки — это полимеры, их составными единицами (мономерами) являются аминокислоты. На долю белков в клетке приходится 50—80% сухой массы. Молекулярная масса белков огромна; например, у белка яйца—яичного альбумина она составляет 36000, у гемоглобина-65 000, у сократительного белка мышц (актомиозин)- 1500000, в то время как у молекул глюкозы она равна 180.
Любая аминокислота состоит из карбоксила (СООН), аминогруппы (NH2) и радикала (R).
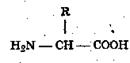
Различаются они только радикалами, которые крайне разнообразны по структуре. Аминогруппа придает аминокислоте щелочные свойства карбоксил — кислотные; этим определяются амфотерные свойства аминокислот. Каждая аминокислота может соединиться с другой посредством пептидных связей (-CO-NH-). В этом случае от аминогруппы одной аминокислоты отделяется ион H+, а от карбоксила другой радикал ОН с образованием молекулы воды. Соединение, возникающее из двух и большего числа аминокислотных остатков, называется полипептидом. В нем между мономерами существуют самые прочные ковалентные связи. Таким образом, природный белок состоит из нескольких десятков или сотен аминокислот, структура же белковой молекулы зависит от вида аминокислот, их количества и порядка расположения в полипептидной цепи.
Последовательность аминокислот в полипептидной цепи определяет первичную структуру молекулы белка от которой в свою очередь зависят последующие уровни пространственной организации и биологические свойства белка. Следующий уровень организации белка - вторичная структура. Она имеет вид спирали. Между изгибами спирали возникают водородные связи, которые слабее ковалентных, но, повторенные многократно, создают довольно прочное сцепление. Витки спирали могут сворачиваться в клубочки, образуя более сложное разветвление, в котором отдельные звенья спирали соединяются более слабыми бисульфидными связями. В этих пунктах в радикалах аминокислот располагаются атомы серы, и соединение между ними создает бисульфидную связь: -S-S-. Так возникает третичная структура молекулы белка. Объединяясь в агрегаты, молекулы белка смогут образовывать четвертичную структуру.
Под влиянием термических, химических и других факторов в белке нарушаются бисульфидные и водородные связи. Это приводит к нарушению сложной структуры — денатурации. При этом третичная структура переходит во вторичную и далее — в первичную. Если первичная структура не разрушается, то весь процесс оказывается обратимым, что имеет исключительно важное значение в восстановлении функциональных свойств белковой молекулы после повреждающих воздействий. Белки можно разделить на глобулярные
(антитела, гормоны, ферменты) и фибриллярные (коллаген, кератин кожи, эластин).
Биологическая роль белков в клетке и во всех жизненных процессах очень велика. На первом месте стоит их каталитическая функция. Поскольку многие внутриклеточные вещества в химическом отношении инертны и их концентрация в клетке незначительна, реакции в клетках должны бы протекать очень замедленно. Однако благодаря присутствию в клетке биокатализаторов реакции проходят исключительно быстро. Все биокатализаторы (они называются ферментами или энзимами) — вещества белковой природы. Каждую химическую реакцию обусловливает свой биокатализатор. Всевозможных реакций в цитоплазме клетки осуществляется очень, много, столь же много и биокатализаторов, контролирующих ход этих реакций.
Строительная функция белков сводится к их участию в формировании всех клеточных органоидов и мембраны. Следующая функция белка — сигнальная. Исследования показывают, что факторы внешней и внутренней среды - температурные, химические, механические и другие способны вызвать обратимые изменения структуры, а значит, и свойств белков. Их способность к обратимым, изменениям структуры под влиянием раздражителей лежит в основе важного свойства живого - раздражимости. Восприятие любого раздражителя связано с изменением пространственной упаковки белковой молекулы.
Перейти на страницу:
1 2 3