Методы определения С-концевой аминокислоты
Для определения природы С-концевой аминокислоты часто используют ферментативные методы. Обработка полипептида карбоксипептидазой, которая разрывает пептидную связь с того конца пептида, где содержится свободная СООН-группа, приводит к освобождению С-концевой аминокислоты, природа которой может быть идентифицирована методом хроматографии.
Предложен также химический метод Акабори (S. Akabori), который основан на гидразинолизе полипептида:
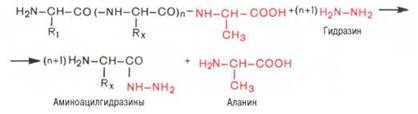
Гидразин, вызывая распад чувствительных к нему пептидных связей полипептида, реагирует со всеми аминокислотами, за исключением С-концевой аминокислоты, поскольку ее карбоксильная группа не участвует в образовании пептидной связи. При этом образуется смесь аминоацил-гидразинов и свободной С-концевой аминокислоты. Последнюю после обработки всей смеси ДНФБ отделяют и идентифицируют хроматографи-чески, для чего образовавшиеся динитрофенилпроизводные аминоацил-гидразинов предварительно экстрагируют уксусно-этиловым эфиром.
С-концевую аминокислоту идентифицируют также путем обработки полипептида восстанавливающим агентом, например боргидридом натрия. В простейшей форме эту процедуру можно представить в следующем виде:
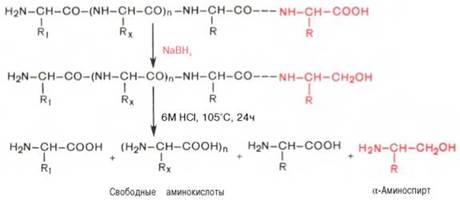
Видно, что в указанных условиях только одна, а именно С-концевая, аминокислота будет превращаться в α-аминоспирт, легко идентифицируемый методом хроматографии. Таким образом, при помощи указанных методов определяют природу N- и С-концевых аминокислот.
Следующий этап работы связан с определением чередования (последовательности) аминокислот внутри полипептидной цепи. Для этого сначала проводят избирательный, частичный (химический и ферментативный), гидролиз полипептидной цепи на короткие пептидные фрагменты, последовательность аминокислот в которых может быть точно определена описанными ранее методами.
Химические методы избирательного и неполного гидролиза основаны на применении таких химических реактивов, которые вызывают селективный, высокоспецифический разрыв пептидных связей, образованных определенными аминокислотами, оставляя незатронутыми остальные пептидные связи. К этим избирательно гидролизующим веществам относятся цианогенбромид, CNBr (по остаткам метионина), гидроксиламин (по связям между остатками аспарагиновой кислоты и глицина), N-бромсукцинамид (по остаткам триптофана). Метионина в составе белков содержится обычно меньше, чем других аминокислот, поэтому обработка CNBr предпочтительнее, так как при этом образуется небольшое число пептидов, первичную структуру которых определяют с помощью рассмотренных ранее методов, всякий раз начиная с определения природы N- и С-концевых аминокислот.
Ферментативные методы гидролиза основаны на избирательности действия протеолитических (вызывающих распад белков) ферментов, расщепляющих пептидные связи, образованные определенными аминокислотами. В частности, пепсин ускоряет гидролиз связей, образованных остатками фенилаланина, тирозина и глутаминовой кислоты, трипсин – аргинина и лизина, химотрипсин – триптофана, тирозина и фенилаланина. Ряд других ферментов, например папаин, субтилизин, проназа и другие бактериальные протеиназы, также используется для неполного гидролиза белков. В результате полипептидная цепь расщепляется на мелкие пептиды, содержащие иногда всего несколько аминокислот, которые отделяют друг от друга сочетанными электрофоретическими и хроматографическими методами, получая своеобразные пептидные карты. Далее определяют чередование аминокислот в каждом индивидуальном пептиде. Завершается работа воссозданием первичной структуры полной полипептидной цепи на основании определения последовательности аминокислот в отдельных пептидах.
Метод составления пептидных карт, получивший образное название «метод отпечатков пальцев», используется при определении сходства или различия гомологичных белков по первичной структуре. Белок инкубируют с каким-либо протеолитическим ферментом. Часто порции белка инкубируют как с пепсином, так и с трипсином. При этом вследствие гидролиза строго определенных пептидных связей образуется смесь коротких пептидов, легко разделяемых с помощью хроматографии в одном направлении и электрофореза – в другом , под углом 90° от первого (пептидная карта).
Перейти на страницу:
1 2 3