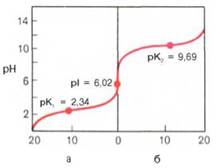
Рис. 1.6. Кривые, полученные при титровании 0,1 М раствора аланина 0,1 М раствором НСl (а) и 0,1 М раствором NaOH (б).
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Будучи растворенными в воде (или в НСl), они способны вращать плоскость поляризованного луча (исключение составляет глицин). Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода (т. е. атома углерода, все четыре валентные связи которого заняты различными заместителями). Величины удельного вращения вправо или влево являются количественной характеристикой оптической активности, и для большинства аминокислот [а]2р составляет от 10 до 30°. Примерно половина аминокислот белков оказалась правовращающей, их обозначают знаком «+» (Ала, Иле, Глу, Лиз и др.), а чуть меньше половины - левовращающей (Фен, Трп, Лей и др.), их обозначают знаком «–». Все эти аминокислоты принадлежат к L-ряду, а величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора, в котором измеряют оптическое вращение.
Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Ниже представлены L- и D-стереоизомеры глицеринового альдегида. Рядом показаны пространственные конфигурации L-и D-аланина:
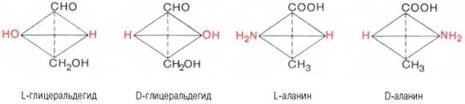
Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида. Следует еще раз подчеркнуть, что символы L и D означают принадлежность данной аминокислоты по своей стереохимической конфигурации к L- или D-ряду, в то время как знак «+» или «–» указывает на направление изменения плоскости поляризации светового луча. Среди белковых аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода. Следовательно, если не в природе, то, во всяком случае, в лаборатории возможно получить четыре стереоизомерные формы этих аминокислот . Для треонина известны все четыре изомера. Если условно обозначить символом L выделенный из природных белков треонин, то его зеркальное отображение называют D-треонином. Два других изомера, получивших наименование диастереоизомеров, или аллоформ, также могут иметь L- и D-формы. Структурные конфигурации всех четырех стереоизомеров треонина можно представить следующими формулами:
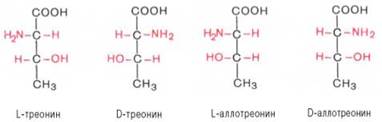
Как отмечалось, в белковой молекуле D-аминокислоты не обнаружены , однако в живой природе они широко распространены.
Перейти на страницу:
1 2 3 4