|
|
Металлургические расчеты
Тепловой баланс реакции восстановления TiCl4
Для расчета количества энергии, введенной при нагреве исходных компонентов до температуры проведения процесса (1100К) и остывания продуктов реакции до температуры 298,15К воспользуемся «Shomate Equation» [5]:
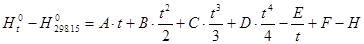
Параметры A,B,C,D,E,F,H берем из справочника [5].
Для расчета теплового эффекта реакции воспользуемся справочными значениями энтальпии образования исходных компонентов и продуктов реакции. |
Термодинамические параметры веществ | | |
Параметр |
TiCl4 |
Mg |
Ti |
MgCl2 | |
A |
106,8573 |
34,30901 |
44,37174 |
92,048 | |
B |
1,049482 |
-7,47103E-10 |
-44,09225 |
-0,000005 | |
C |
-0,2843 |
6,14621E-10 |
31,70602 |
4,77E-07 | |
D |
0,024257 |
-1,59824E-10 |
0,052209 |
1,14E-07 | |
E |
-1,043516 |
-1,15201E-11 |
0,036168 |
-0,000005 | |
F |
-798,5666 |
-5,439367 |
-12,72011 |
-634,343 | |
H |
-763,1616 |
4,790011 |
0 |
-601,577 | |
H1100-H298.15, кДж/моль |
83,60436175 |
27,510533 |
23,46612676 |
68,48680177 | |
Энтальпия образования
ΔH, кДж/моль |
-804,2 |
0 |
0 |
-641,3 |
Рассчитываем выделение тепла от экзотермии реакции используя энтальпии образования принимающих участие в реакции веществ:
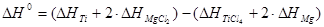
Аналогично, используя параметр H1100-H298.15, вычисляем разницу теплоты получаемых и исходных компонентов (теплота нагрева до 1100К и остывания до 298.15К):
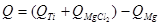
Таким образом, количество тепла, подлежащее отведению составит: 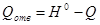
Пересчитывая граммы в моли, получаем суммарный тепловой эффект реакции при получении 1кг металлического титана и заполняем таблицу: |
Параметр |
TiCl4 |
2Mg |
Ti |
2MgCl2 |
Сумма | |
масса, г |
3958 |
1021 |
1000 |
3958 | | |
молярная масса, г/моль |
190 |
49 |
48 |
190 | | |
кол-во, моль |
20,83157895 |
20,83673469 |
20,83333333 |
20,83157895 | | |
энтальпия образования, кДж |
-16752,75579 |
0 |
0 |
-13359,29158 |
3393,464211 | |
H1100-H298.15, кДж |
1741,610862 |
573,2296774 |
488,8776407 |
1426,688218 |
-399,2746809 | | | | | |
Итого |
3792,738891 |
Перейти на страницу: 1 2 3 |
|
|
|