3As2S3 + 28HNO3+ 4Н2О = 6H3AsO4+ 9H2SO4 + 28NO.
Если числа электронов, отдаваемых молекулой восстановителя и принимаемых молекулой окислителя, имеют общий делитель, то на него можно сократить основные коэффициенты, например:
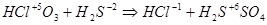
|
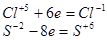
|
8
24
6 |
4
3 |
(восстановление)
(окисление) |
Наибольший общий делитель равен 2. Коэффициенты в уравнении будут
4HСlO3 + 3H2S = 4HCl + 3H2SO4.
Электронный баланс в данном случае 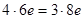 .
.
4. Если число участвующих в реакции атомов нечетное, а в результате ее должно получиться четное число атомов хотя бы одного из изменяющихся СО элементов, то основные коэффициенты удваиваются:
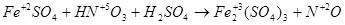
|
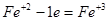
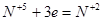
|
3
3
1 |
6
2 |
(окисление)
(восстановление) |
6FeSO4 + 2HNO3 + 3H2SO4 = 3Fe2(SO4)3 + 2NO + 4H2O.
В рассмотренном примере в протекании окислительно-восстановительной реакции принимает участие серная кислота. Она необходима для связывания образовавшегося трехвалентного железа. Нужное количество молекул H2SO4 определяется после расстановки коэффициентов перед продуктами реакции в соответствии с основными коэффициентами в левой части уравнения. Водород или кислород уравниваются в последнюю очередь добавлением молекул воды.
5. Окислитель или восстановитель, кроме основной окислительно-восстановительной реакции, расходуется также на связывание образующихся продуктов реакции. Например:
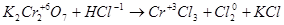
|
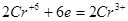
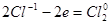
|
1
3 группы по два иона хлора, всего шесть ионов хлора |
(восстановление)
(окисление) |
 K2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
K2Cr2O7 + 6HCl 2CrCl3 + 3Cl2 + 2KCl.
На связывание продуктов реакции в соответствии с основными коэффициентами необходимо 8 молекул HCl, которые не окисляются (на образование 2 молекул CrCl3 и 2 молекул KCl). Таким образом:
K2Cr2O7 + 6HCl + 8HCl ® 2CrCl3 + 3Cl2 + 2KCl.
на восстановление на связывание
Уравниваем водород или кислород, добавив в правую часть уравнения 7 молекул воды H2O, и получим окончательно:
K2Cr2O7 + 14HCl ® 2CrCl3 + 3Cl2 + 2KCl + 7H2O.
6. 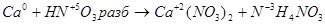
|
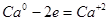
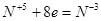
|
8
2 |
4
1 |
(окисление)
(восстановление) |
Основные коэффициенты 4 и 1:
 4Сa + HNO3 4Ca(NО3)2 + NH4NO3.
4Сa + HNO3 4Ca(NО3)2 + NH4NO3.
На связывание продуктов реакции требуется в соответствии с основными коэффициентами 9 молекул HNO3:
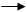

 4Сa + HNO3 + 9HNO3 4Ca(NО3)2 + NH4NO3 + 3H2O.
4Сa + HNO3 + 9HNO3 4Ca(NО3)2 + NH4NO3 + 3H2O.
на окисление на связывание
7. Оба элемента - и отдающий и принимающий электроны - находятся в одной молекуле. Для нахождения основных коэффициентов подобные процессы рассматривают как бы идущими справа налево:
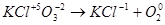
|
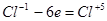 6 6
24
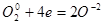 4 4
|
4
6 |
2
3 |
(окисление)
(восстановление) |
Перейти на страницу:
1 2 3