АО могут образовывать МО, если энергии соответствующих АО близки по величине и АО имеют одинаковую симметрию относительно оси связи.
Волновые функции, или орбитали, водорода 1s могут дать две линейные комбинации – одну при сложении, другую - при вычитании (рис. 2.2).
Когда волновые функции складываются, то в области перекрывания плотность электронного облака, пропорциональная ψ2, становится больше, между ядрами атомов создается избыточный отрицательный заряд и ядра атомов притягиваются к нему. МО, полученная сложением волновых функций атомов водорода, называется связывающей.
Если волновые функции вычитаются, то в области между ядрами атомов плотность электронного облака становится равной нулю, электронное облако «выталкивается» из области, находящейся между атомами. Образующаяся МО не может связывать атомы и называется разрыхляющей.
Поскольку s-орбитали водорода образуют только σ-связь, то полученные МО обозначаются σcв и σр. МО, образованные 1s-атомными орбиталями, обозначаются σcв1s и σр1s.
На связывающей МО потенциальная (и полная) энергия электронов оказывается меньше, чем на АО, а на разрыхляющей – больше. По абсолютной величине возрастание энергии электронов на разрыхляющих орбиталях несколько больше уменьшения энергии на связывающих орбиталях. Электрон, находящийся на связывающих орбиталях, обеспечивает связь между атомами, стабилизируя молекулу, а электрон на разрыхляющей орбитали дестабилизирует молекулу, т.е. связь между атомами ослабевает. Еразр. > Есв.
МО образуются и из 2р-орбиталей одинаковой симметрии: связывающая и разрыхляющая σ-орбитали из 2р-орбиталей, расположенных по оси х. Они обозначаются σcв2р и σр2р. Связывающая и разрыхляющая p-орбитали образуются из 2рz-орбиталей. Обозначаются они соответственно πсв2рz, πp2pz. Аналогично образуются πсв2ру и πр2ру-орбитали.
Заполнение МО. Заполнение МО электронами происходит в порядке увеличения энергии орбиталей. В случае, если МО имеют одинаковую энергию (πсв- или πр-орбитали), то заполнение происходит по правилу Хунда так, чтобы спиновый момент молекулы был наибольшим. Каждая МО, как и атомная, может вместить два электрона. Как отмечалось, магнитные свойства атомов или молекул зависят от наличия неспаренных электронов: если в молекуле есть неспаренные электроны, то она парамагнитна, если нет – диамагнитна.
Рассмотрим ион 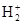 .
.
Из схемы видно, что единственный электрон размещается по σcв - МО. Образуется устойчивое соединение с энергией связи 255 кДж/моль, длиной связи - 0,106 нм. Молекулярный ион 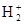 парамагнитен. Если принять, что кратность связи, как в методе ВС, определяется количеством электронных пар, то кратность связи в
парамагнитен. Если принять, что кратность связи, как в методе ВС, определяется количеством электронных пар, то кратность связи в 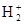 равна ½. Записать процесс образования
равна ½. Записать процесс образования 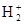 можно следующим образом:
можно следующим образом:
Перейти на страницу:
1 2 3 4