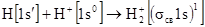 . .
Эта запись означает, что на σcв МО, образованной из 1s АО, находится один электрон.
Молекула обычного водорода содержит уже два электрона с противоположными спинами на σcв1s-орбитали: 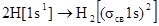 . Энергия связи в Н2 больше, чем в . Энергия связи в Н2 больше, чем в 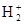 - 435 кДж/моль, а длина связи (0,074 нм) – меньше. В молекуле Н2 имеется одинарная связь, молекула диамагнитна. - 435 кДж/моль, а длина связи (0,074 нм) – меньше. В молекуле Н2 имеется одинарная связь, молекула диамагнитна.
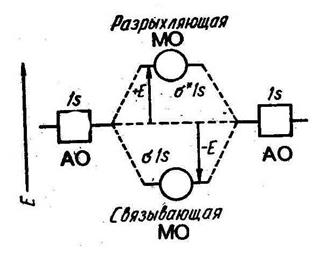
Рис. 2.3. Энергетическая диаграмма АО и МО в системе их двух атомов водорода.
Молекулярный ион 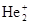 ([He[1s2]+He+[1s1] ® He+2[(sсв1s)2(sр1s)1]) имеет уже один электрон на σразр.1s-орбитали. Энергия связи в ([He[1s2]+He+[1s1] ® He+2[(sсв1s)2(sр1s)1]) имеет уже один электрон на σразр.1s-орбитали. Энергия связи в 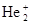 - 238 кДж/моль (по сравнению с Н2 понижена), а длина связи (0,108 нам) - увеличена. Кратность связи равна ½ (кратность связи равна половине разности числа электронов на связывающих и разрыхляющих орбиталях). - 238 кДж/моль (по сравнению с Н2 понижена), а длина связи (0,108 нам) - увеличена. Кратность связи равна ½ (кратность связи равна половине разности числа электронов на связывающих и разрыхляющих орбиталях). | |
Li2 |
(Be)2 |
B2 |
N2 |
O2 |
(Ne)2 |
CO |
NO | |
σp2px |
– |
– |
– |
– |
– |
¯ |
– |
– | |
πp2py, πp2pz |
– – |
– – |
– – |
– – |
, |
¯,¯ |
– – |
,– | |
σcв2px |
– |
– |
– |
¯ |
¯ |
¯ |
¯ |
¯ | |
πcв2py, πcв2pz |
– – |
– – |
, |
¯,¯ |
¯,¯ |
¯,¯ |
¯,¯ |
¯,¯ | |
σр2s |
– |
¯ |
¯ |
¯ |
¯ |
¯ |
¯ |
¯ | |
σcв2s |
¯ |
¯ |
¯ |
¯ |
¯ |
¯ |
¯ |
¯ | |
Кратность связи |
1 |
0 |
1 |
3 |
2 |
0 |
3 |
2 ½ | |
Энергия связи, кДж/моль |
105 |
– |
288 |
941 |
566 |
– |
1070 |
677 |
Перейти на страницу: 1 2 3 4 |