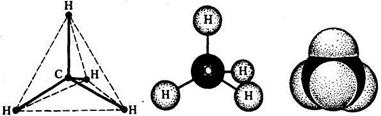
Рис. 7 Модели пространственного строения молекулы метана:
А – тетраэдрическая; б – шаростержневая; в – по Бригдебу.
Оказалось, что и при одинаковой последовательности связей в молекулах, возможна изомерия, обусловленная различным расположением атомов в пространстве. Этот вид изомерии называется пространственной изомерией или стереоизомерией.
Стереоизомеры могут содержать асимметричный атом углерода, соединенный с четырьмя различными атомами или атомными группами (рис. 8). Органические вещества, содержащие асимметричный углеродный атом, существуют в виде двух изомерных молекул с различным пространственным расположением атомов. Эти стереоизомерные молекулы относятся друг к другу как предмет к зеркальному изображению и называются энантиомерами (асимметричный атом углерода в формулах обозначается звездочкой):
CH3—C*HOH—COOH молочная кислота
Стереоизомеры, обладая одинаковыми химическими и физическими свойствами, отличаются между собой оптической активностью, т.е. по отношению к поляризованном свету. Каждый из них вращает плоскость поляризованного луча в противоположном направлении, являясь оптическим антиподом.
Поляризация связей
Когда ковалентной связью соединяются одинаковые атомы, обобщенная электронная пара в равной степени принадлежит им обоим. Иначе обстоит дело, если ковалентной связью соединены атомы различных элементов,
Рис. 8 Энантиомеры молочной кислоты.
обладающие различной электроотрицательностью (ЭО) (т.е. способностью притягивать обобщенные электроны, образующие ковалентную связь). В этом случае обобщенная электронная пара оказывается в той или иной мере смещенной (оттянутой) сторону более ЭО- атома. В результате у этого атома возникает некоторый (избыточный или частичный) отрицательный заряд, а у атома, от которого электронная пара оттянута, - равный по величине положительный заряд. Связь между такими атомами является поляризованной связью.
Так, например, в молекуле хлора обобщенная электронная пара в одинаковой мере принадлежит обоим атомам, в молекуле же органического вещества – хлористого метила CH3Cl пара электронов, осуществляющая связь между хлором и углеродом, смещена в сторону несколько более электроотрицательного хлора (и условно может быть изображена d+ и d-):
Cl : Cl H3Cd+ : Cld- H3Cd+ ® Cld-
I II III
У хлора возникает некоторый отрицательный заряд, у углерода – положительный, ковалентная связь между этими атомами в хлористом метиле поляризована. Как показано в формуле II, частичные заряды атомов, соединенных поляризованной связью, принято обозначать греческой буквой d (дельта) со знаком плюс и знаком минус соответственно. Смещение электронной пары в поляризованной простой ковалентной связи обычно обозначают стрелкой на середине черточки, выражающей эту связь, как представлено в формуле III.
Чем более поляризована связь, т.е. чем больше осуществляющая ее пара смещена к одному из атомов, тем больше эта связь по своему характеру приближается к ионной связи и тем выше реакционная способность соединенных такой связью атомов.
Степень поляризации связи между двумя атомами, а следовательно, и ее прочность, зависят от влияния других соединенных с ними атомов или атомных групп. В частности, связь С—С между двумя формально одинаковыми углеродными атомами, может быть поляризованной, если каждый из них в свою очередь соединен с различными атомами или группами. Особенно склонны к поляризации двойные и тройные связи.
В молекулах с двойными связями p-электроны, образующие p-связь, смещены в направлении более электроотрицательного атома:


