С точки зрения электролитической диссоциации соли можно рассматривать как продукт взаимодействия кислоты и основания:
х(кислота) + у(основание) → соль + вода,
где х и у – переменное количество эквивалентов взаимодействующих между собой кислот и оснований.
В зависимости от соотношения х и у различают следующие виды солей, диссоциирующих в водных растворах по схеме:
при х > у – кислые соли
2H2SO4 + Mg(OH)2 ® Mg(HSO4)2 + 2H2O;
Mg(HSO4)2 <=> Mg2+ + 2HSO4- ;
при х = у – средние (нормальные) соли
H2SO4 + Mg(OH)2 ® MgSO4 + 2H2O;
MgSO4 <=> Mg2+ + SO42-;
при х < у – основные соли
H2SO4 + 2Mg(OH)2 ® (MgOH)2SO4 + 2H2O;
(MgOH)2SO4 <=> 2MgOH+ + SO42-;
Как правило, все соли относятся к сильным электролитам.
Сильные электролиты в водных растворах полностью диссоциированы на ионы.
В воде, являющейся растворителем, статистически равномерно распределяются полностью гидратированные катионы и анионы сильного электролита. Электростатическое взаимодействие между ионами ослабляется до минимума большими расстояниями между ними и гидратными оболочками, выполняющими экранирующую роль.
В отличие от сильных электролитов диссоциация слабых электролитов протекает обратимо и устанавливается равновесие.
Количественно процесс диссоциации может быть охарактеризован рядом величин: степенью электролитической диссоциации a, константой электролитической диссоциации К и др.
Степень электролитической диссоциации a – это отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества в растворе.
a может измеряться в долях единицы или в процентах. a = 0, если диссоциация отсутствует; a = 1 или a = 100 % при полной диссоциации электролита.
К процессу электролитической диссоциации, как к обратимому процессу, можно применять принцип Ле Шателье и выявить влияние внешних факторов на состояние равновесия, приводящее к изменению значения a.
Для смещения равновесия
К+А- + хН2О <=> К+(Н2О)к + А-(Н2О)а
слева направо, то есть в сторону диссоциации, необходимо увеличить массу растворителя. Это означает, что:
диссоциация слабых электролитов проходит эффективнее в разбавленных растворах, чем в концентрированных. Иными словами, a возрастает с уменьшением концентрации электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе.
так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры.
Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита:
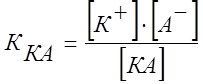 ,
,
где [К+], [A-] и [KA] - концентрации в растворе ионов 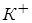 и
и 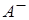 (в г-ион/л) и недиссоциированного соединения КА (в моль/л).
(в г-ион/л) и недиссоциированного соединения КА (в моль/л).
Чем больше К, тем электролит лучше распадается на ионы. Для данного электролита значение К постоянно при определенной температуре и в отличие от a не зависит от концентрации.
Связь между константой К и степенью диссоциации a может быть найдена следующим образом. Концентрация ионов К+ и А- в растворе равна
Перейти на страницу:
1 2 3